本文作者Heinz Anderle(高级科学家)和 Alfred Weber(资深经理)均来自Baxalta Innovations公司(Baxalta Innovations几经易主终归武田 Takeda旗下)。Baxalta Innovations与CSL Behring、Grifols是全球在免疫球蛋白、白蛋白和提取VIII因子的前三强企业。文章”Variable Pathlength Fiber-Optic Spectrophotometry for Protein Determination in Immunoglobulin Concentrates“,由于翻译水平有限,详细内容请参考原文。
solovpe 光程 样品
自 从分光光度法用于精准测量纯化的蛋白质浓度,已经有几十年了。 一般来说,消光系数(通常在280nm处)是通过实验或根据氨基酸的组成计算得出的。 在测量吸光度时,为了降低仪器的误差,样品需要稀释至吸光度为0.6–0.7/cm。 虽然重量稀释法可以使样品制备步骤的误差最小化,但对于大量样品的测量,通常工作量也会很大,而且还要确保烧瓶和比色皿等器材的清洁。
为了克服传统分光光度法的局限性,最近出现了一种基于光程变化条件下测量吸光度增量的分光光度技术(1)。这种光程的变化是通过光纤在样品溶液中的步进来实现的,每一个步进都有一个吸光度读数,然后根据吸光度与光程计算出斜率 光谱
在血浆分离中,可以用静脉注射免疫球蛋白G(IVIG)评估鉴定斜率光谱技术的适用性,IVIG主要是通过色谱法进行高度纯化,然后配制成浓缩液体的。Gammagard液体是一种多价IgG产品,它在250 mM甘氨酸溶液中蛋白质含量10%,纯度可超过98%,pH=4.8(3)。目前,蛋白质主要是用凯氏定氮法测定总氮含量和非蛋白氮含量的(4)。尽管试剂的滴加已经实现自动化,最大限度地减少了对硫酸、氢氧化钠溶液和盐酸等有害物质的人工处理,但凯氏技术(Kjeldahl)仍然是一种时间和劳动密集型的方法,而且它在使用时还必须有效地去除酸性烟雾。
另一种可用于检测Gammagard液体的氮含量的检测技术是Dumas法,它不需要使用危险液体,而是使用一股氧氦气流(支持样品燃烧),样品放在钢坩埚或一次性锡胶囊中,然后把这些容器放在熔炉中电加热至约1000°C(5)。虽然Dumas方法具有更高的通量
在含有约0.5 mg IgG/mL(生理盐水作为稀释剂和空白)的样品稀释液中,蛋白质成分的批次间一致性,可以通过紫外(UV)吸收法进行测量,作为氮含量检测技术的替代方法。10%的IgG稀释到0.5 mg IgG/mL,必须在容量瓶中稀释约200倍。在320 nm处测量浊度并进行校正,然后根据凯氏定标数据,消光系数E0.1%被校准为1.399/cm。
对于凯氏定氮法、Dumas燃烧法测量蛋白质溶液,以及使用重量稀释法测量蛋白的UV吸光度,首先都需要在振荡管密度计中测量出样品的密度。而对于斜率光谱技术(SoloVPE)来说,它不用测量密度就可以产生相同的测量结果,并且制备和测量步骤可以简化为一个单步程序,同时省去了设备的清洁,减少了试剂的消耗,节省了电能消耗。
斜率光谱分析技术与凯氏定氮法的等效性,首先必须通过遵守AOAC精密度和准确度的验收标准来进行证明:在分析物的浓度为10%时,回收率必须保持在98–102%之间,精密度要优于2.8%(6,7),准确性要与独立的、经过验证的参考方法(如Kjeldahl消化法)一致。批间和批内分析精度必须根据监管指南中概述的6次重复测量来确定;线性应至少为工作水平的80-120%。此外,由于IVIG的商业重要性,两种方法之间的偏差(结果的差异)应该尽可能小,如数据集(8)的Bland-Altman统计分析所示。
目前市面上有一种20%的皮下注射IgG浓缩液,与许可上市的10%IVIG浓缩液相比,都是在相同的微酸环境中进行配制的。因此说, 5–25%的IgG浓度,覆盖了整个生产中的浓度范围。但对于流变学研究来说,实验中获得了更高的IgG浓度(高达38%)(9)。
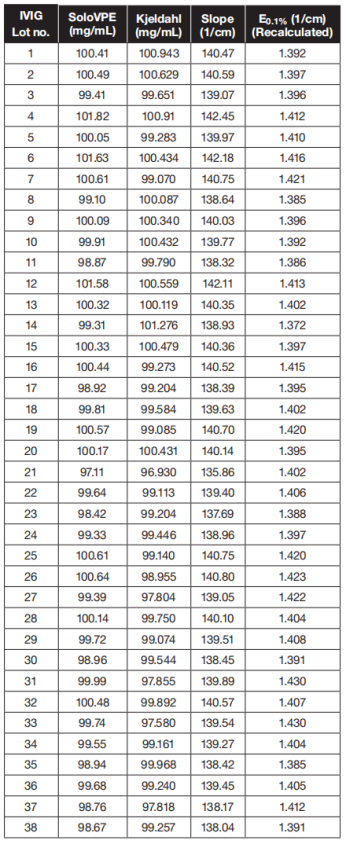
表 1 :各 批次 10%IgG的 SoloVPE和 Kjeldahl蛋白浓度结果的比较
图 1: SoloVPE的光纤棒浸入荧光素溶液中的光路照片
材料和方法
从38个批次原液瓶中,使用消毒注射器抽取出已知浓度的10%IVIG(Gammagard液体,其蛋白浓度是根据凯氏定氮法结合着溶液密度测定的)。通过离心超滤(Centriprep 10 kDa)0.03%叠氮化物保存的等分试样制备出高实验性能的IgG浓缩物(目标:30%以上),并保留渗透液以便将稀释液(5%、10%、15%、20%和25%IgG)与储备浓缩物(32%)混合。在这些制剂中,蛋白质浓度是通过280nm紫外吸收测定(320nm浊度校正)以及通过VarioMax分析仪中的Dumas燃烧法测定,以渗透物(甘氨酸/叠氮化物)为基准值。固体乙酰苯胺作为氮含量的标准物,假定Kjeldahl和Dumas测定(10)的氮含量为16%。 对于常规的紫外吸收测量法,使用了带有标准1厘米石英比色皿的日立U-3000分光光度计和带有弹簧夹支架中的0.1mm薄层石英比色皿的日立U-3310高灵敏度分光光度计。而SoloVPE可变光程分光光度计,它包括可变光程的光纤/探测器单元和作为光源的安捷伦Cary60单元(由C Technologies Inc提供),以及一次性塑料比色皿和聚酰亚胺涂层0.6毫米直径的石英“光纤棒”作为消耗品。
可变光程分光光度法与常规分光光度法
在SoloVPE中,光源的单色光通过传输光缆传递到光纤棒,并在光纤棒末端和塑料比色皿底部之间的可调光程中被样品溶液吸收(图1),然后比色皿下方的检测器(硅光电二极管)测量透射光强度。在溶液中,光程的更小步进d为5 μm,并且在所有10个测量点处读取吸光度值A。为了保持线性回归系数(R2≥0.999),斜率计算至少需要五个测量点的结果。然后将吸光度与光程经回归计算所得的斜率值(ΔA/Δd)除以质量比或摩尔消光系数(E或ε),可分别计算出质量或摩尔浓度。
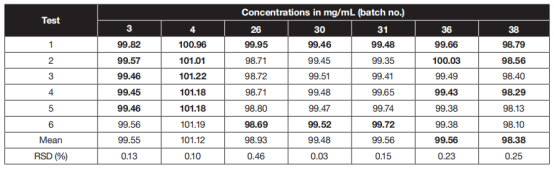
表 2 : 6个 10%IgG批次的批内精密度结果 (批号与表 1相同 ), RSD=的相对标准差
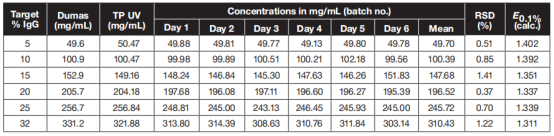
表 3 : 用Dumas 、总蛋白紫外光度法(TP UV) 和SoloVPE 法测定的蛋白浓度,以及6 种实验性的5-32%IgG 溶液中SoloVPE 的批间精度结果,RSD= 相对标准差
分光光度测量法本质上受到探测器的暗信号和噪声以及模拟/数字信号转换器的位深度的限制。在3个吸光度单位以上(即0.001残余传输)时,可以很容易地观察到由单色器杂散光引起的线性偏差。高灵敏度分光光度计,如日立U-3310及其附加的辅助杂散消光单色器,可以将吸光度灵敏度范围延伸到大约3到4个吸光度单位(即从0.001到0.0001残余传输),在此之上,普通红色敏感光电倍增管(PMT)的热探测器噪声成为主导。对于常规的紫外-可见分光光度法(UV-VIS)仪器,为探测器配备蓝色敏感的PMT,并将其从环境温度冷却到-20°C,不是一个可行的选择。 一种可以直接克服这些测量上限且对用户友好的方法,就是通过使用微量薄层比色皿来减小光程。一些制造商提供了光程为0.5、0.2、甚至0.1毫米厚度的比色皿,以及一个可拆卸的盖窗。Watson 和 Veeraragavan(11)已经描述了这种技术用于测量浓度在90 mg/mL以下的单克隆抗体的适用性。虽然在0.1毫米比色皿中10% IgG的吸光度值为1.4,不受杂散光、暗信号或噪声的干扰,但作者也根据经验劝阻常规使用这样的比色皿,因为它需要细致的处理和繁琐的清洁工作,由于样品的高粘度,实际中不可能应用样品浓度超过20%的IgG。
结果和讨论
10% IgG溶液和批间的精密度
对于所有38批10%IgG,使用SoloVPE测得的蛋白浓度数据与凯氏定氮法吻合较好(见表1)。重新计算的E0.1%的平均消光系数为1.404±0.013/cm,与200倍稀释溶液中总蛋白(TP )紫外方法UV测量的校准值E0.1%=1.399/cm很吻合,尤其是考虑到测量的固有不确定性时。 采用SoloVPE和凯氏定氮法两种方法进行蛋白浓度测定,数据结果表明,两种方法吻合较好(在95%的置信区间下)。平均偏倚为-0.33%,95%的一致性极限范围从1.56%到2.21%,当分析物浓度为10%时,两者均不超过98%和102%的可接受回收率极限。 10% IgG溶液的检测内精密度测试,在一个单独的系列中运行,包括6个连续读出值的样品。由于样品溶液可以直接使用,无需进行任何制备程序,因此变异系数不超过0.5%(见表2)。
5 - 25% IgG溶液和批内精密度
根据初始蛋白浓度和密度值,从32%的浓缩液和渗透液中称重,制备稀释液。为了进行比较,基于密度的样品剂量的稀释剂是在Varomax燃烧自动机中采用Dumas方法进行分析的。采用单TP紫外测定法测定原液的TP紫外浓度为325.46mg/mL,根据所有的6次TP紫外测量(五种稀释和储备)的总稀释系数的平均值为321.88±3.59mg/mL。对于不需稀释的SoloVPE测量,这种特别粘性的样品很难在不产生气泡的情况下填充到样品比色皿中。 而5%和10%的溶液使用SoloVPE测量,所有10数据点给出了一个很好的斜率回归曲线,若是需要测量更高的浓度,随着浓度增加,可适当省略肉眼可见的偏差数据点,使斜率得到调整,通常在吸光度值>1.6时会出现需要调整的情况。 对于很高的浓度,只有重新计算斜率, SoloVPE和其他方法之间的差异才能降低到约-7%。通过6天的测定,结果显示这些样品的批内精密度是合理的,它的相对标准差(RSDs)低于1.5%(见表3)。表3还显示了使用这些数据重新计算的消光系数E0.1%。 有趣的是,重新计算的消光系数E0.1%(基于紫外方法的TP浓度)的变化表明了一种浓度依赖性,它可能是大分子拥挤的光学效应,特别是在极高浓度(12,13)下,散射(和浊度)的增量减少了。据我们所知,这种光衰减的变化(即吸光度和浊度的总和)到目前为止还没有被描述过。 虽然对IgG的这种影响的数学建模和实验证据超出了本研究的范围,但获得的数据表明,紫外UV方法测总蛋白TP的消光系数为1.399/cm(针对250mm甘氨酸中的10% IgG进行校准),不建议使用SoloVPE测量20% IgG浓缩液及其更高浓度的超滤原液。
仪器性能和系统适用性测试
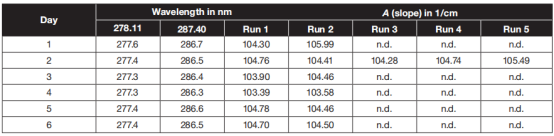
波长的准确性通常是由含Ho(ClO4)3的高氯酸标准溶液的密封比色皿来确定的,它测试时需要一个单独的SoloVCA适配器,用以通过传输光缆连接到光源。 使用跟踪光标从软件窗口手动读出波长位置。在仪器的固定狭缝宽度为1.5 nm时,278.11 nm的波长误差为- 0.5 ~ - 0.8 nm,287.40nm(14)的波长误差为- 0.7 ~ - 1.1 nm(见表IV)。
表 4 :使用 Cary60分光光度计测定的波长结果和来自 SoloVPE的光度检查结果; n.d.=无数据
为建立光度计系统的适用性测试,用日立U-3310分光光度计在0.1毫米比色皿测定的吸光度为117.25/厘米,日立U3000分光光度计为114.00/厘米,U-3310为113.00/厘米。在SoloVPE中,其范围始终在103到106/cm之间(见表4),造成这种差异的原因尚不清楚。
结论
当采用目前的放行方法测量IgG浓度时,SoloVPE和凯氏定氮法两个方法之间得到了合理的、精确的一致性。虽然消光系数受到了浓度引起的大分子拥挤效应的影响(根据UV法校准的1 mg IgG/mL的消光系数E0.1%为1.399/cm),但对于10%浓度的IgG,使用SoloVPE技术测量仍然有效,而且满足了AOAC的回收率和精度标准。由于不需要重新校准消光系数,可变光程分光光度法成为了一种可行的即时总蛋白测量方法,用来确定10%的IgG溶液浓度。然而,对于更高的浓度,如20%的IgG溶液,必须对消光系数进行重新校准。 SoloVPE作为一种创新的、节省时间和资源的“一步法”技术,它不用样品预稀释、不需使用危险试剂、避免高能耗。在蛋白溶液具有恒定组成和固定消光系数的情况下,SoloVPE可变光程分光光度法可以取代目前的凯氏定氮法和Dumas方法进行蛋白质的浓度测定。
参考文献
1. M.C. Salerno, T. Shih, and C. Harriston/C Technologies, Inc., “Interactive Variable Pathlength Device”, US patent application US2009/0027678, January 2009. 2. S. Huffman, K. Soni K, and J. Ferraiolo, Bioproc. Int. 12 (8), pp. 66–73 (2014). 3. W. Teschner et al., Vox Sang. 92, pp. 42–55 (2006). 4. J. Kjeldahl, Fresenius’ Z. Anal. Chem. 22, pp. 366–382 (1882). 5. P. Blondel and L. Vian, Ann. Pharm. Fr. 51 (6), pp. 292–298 (1993). 6. L. Huber, LC–GC Int. 1998 (2), pp. 96–105 (1998). 7. I. Taverniers, M. de Loose, and E. van Bockstaele, Trends Anal. Chem. 23, pp. 536–551 (2004). 8. J.M. Bland and D.G. Altman, Lancet 8476 (1), pp. 307–310 (1986 Feb. 8). 9. V. Burckbuchler et al., Eur. J. Pharm. Biopharm.76, pp. 351–356 (2010). 10. E. Brand, B. Kassell, and L.J. Saidel, J. Clin. Invest. 23, pp. 437–444 (1944). 11. L. Watson and K. Veeraragavan, Biopharm Int.27 (2), pp. 26–37 passim (2014). 12. C. Fernandez and A.P. Minton, Anal. Biochem. 381 (2), pp. 254–257 (2008). 13. C. Fernandez and A.P. Minton, Biophys. J. 96, pp. 1992–1998 (2009). 14. J.C. Travis et al., J. Phys. Chem. Ref. Data 34, pp. 41–56 (2005).